Acide dicarboxylique
Les acides dicarboxyliques Écouter sont des composés organiques possédant deux fonctions carboxyle. La formule moléculaire de ces composés est généralement notée HOOC-R-COOH, où R peut être un groupe alkyle, alcényle, alcynyle ou aryle.
Les acides dicarboxyliques peuvent être utilisés pour préparer des copolymères tels des polyesters polyamides.
Propriétés
[modifier | modifier le code]En général, les acides dicarboxyliques ont le même comportement chimique et la même réactivité que les acides monocarboxyliques.
L'ionisation du second groupe carboxylique est en général moins facile que la première, donnant à la molécule deux pKA comme la plupart des diacides. Lorsque l'un des groupes carboxyle est réduit en groupe aldéhyde, on appelle la nouvelle molécule « acide aldéhydique ».
Dans l'environnement
[modifier | modifier le code]Les microplastiques perdus en mer se dégradent sous l'effet des UV (dégradation photochimique induite par les UV-B en particulier).
Ils libèrent rapidement diverses molécules organiques dans l'eau, ce qui a été montré au moins pour le polyéthylène, le polypropylène, le polystyrène et le PET. Selon une étude récente (2018), parmi 22 produits de dégradation libérés par ces 4 types de plastiques, ce sont des acides dicarboxyliques qui dominent[1].
Acides linéaires saturés
[modifier | modifier le code]La formule générale des acides dicarboxyliques saturés est HO2C(CH2)nCO2H[2].
| Nom commun | Nomenclature systématique | Formule chimique | Structure chimique | pKA1 | pKA2 |
|---|---|---|---|---|---|
| Acide oxalique | acide éthanedioïque | 1,27 | 4,27 | ||
| Acide malonique | acide propanedioïque | 2,85 | 5,05 | ||
| Acide succinique | acide butanedioïque | HOOC-(CH2)2-COOH | 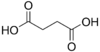 |
4,21 | 5,41 |
| Acide glutarique | acide pentanedioïque | 4,34 | 5,41 | ||
| Acide adipique | acide hexanedioïque |  |
4,41 | 5,41 | |
| Acide pimélique | acide heptanedioïque | 4,50 | 5,43 | ||
| Acide subérique | acide octanedioïque |  |
4,526 | 5,498 | |
| Acide azélaïque | acide nonanedioïque | 4,550 | 5,498 | ||
| Acide sébacique | acide décanedioïque |  |
4,720 | 5,450 | |
| acide undécanedioïque | |||||
| acide dodécanedioïque (en) |  |
||||
| Acide brassylique | acide tridécanedioïque | ||||
| acide tétradécanedioïque | HOOC-(CH2)12-COOH | ||||
| acide pentadécanedioïque | HOOC-(CH2)13-COOH | ||||
| Acide thapsique | acide hexadécanedioïque |
- Contrairement à ce que son nom peut laisser croire, l'acide adipique (du latin adipis, graisse) n'est pas un constituant normal des lipides naturels, mais est un produit de la peroxydation des lipides. Il fut obtenu pour la première fois par oxydation de l'huile de ricin (acide ricinoléique) par l'acide nitrique. Il est maintenant produit à l'échelle industrielle par oxydation du cyclohexanol ou du cyclohexane, principalement pour la production du Nylon 66 (en). Il est également utilisé dans la production d'adhésifs, de plastifiants, d'agents gélatinisants, de fluides hydrauliques, de lubrifiants, d'émollients, de mousses polyuréthane, de tannins pour cuir, d'uréthane et d'acidulants (en) alimentaires.
- L'acide pimélique (du grec pimelh, graisse) fut aussi isolé pour la première fois d'huile oxydée. Des dérivés de l'acide pimélique sont impliqués dans la biosynthèse de la lysine.
- L'acide subérique fut obtenu pour la première fois par oxydation de liège (en latin, suber). Cet acide est également produit lorsque l'huile de ricin est oxydée. L'acide subérique est utilisé dans la fabrication de résines alkydes et dans la synthèse de polyamides (variantes nylon).
- Le nom de l'acide azélaïque vient du fait qu'il est le produit de l'oxydation de l'acide nitrique (ou acide azotique) sur l'acide oléique ou acide élaïdique. Il a été détecté parmi les produits de graisses rances. Son origine explique sa présence dans des échantillons mal conservés d'huile de lin et dans des spécimens d'onguent retirés de tombes égyptiennes vieilles de 5000 ans. L'acide azélaïque a été préparé par oxydation de l'acide oléique avec du permanganate de potassium, mais il l'est maintenant par clivage oxydatif de l'acide oléique avec de l'acide chromique ou par ozonolyse. L'acide azélaïque est utilisé, sous forme d'esters simples ou d'esters à chaîne ramifiée, dans la fabrication de plastifiants (pour les résines de chlorure de vinyle, le caoutchouc), de lubrifiants et de graisses. L'acide azélaïque est aujourd'hui utilisé en cosmétique (traitement de l'acné). Il présente des propriétés bactériostatiques et bactéricides contre une variété de micro-organismes aérobies et anaérobies présents sur les peaux acnéiques. L'acide azélaïque a été identifié comme une molécule qui s'accumule à des niveaux élevés dans certaines parties des plantes, et s'est révélé capable d'améliorer la résistance des plantes aux infections[3].
- L'acide sébacique tient son nom du suif (en latin, sebum). Louis Jacques Thénard a isolé ce composé à partir des produits de la distillation du suif de bœuf en 1802. Il est produit industriellement par la fission alcaline de l'huile de ricin[4]. L'acide sébacique et ses dérivés ont des utilisations industrielles variées comme plastifiants, lubrifiants, huiles de pompe à diffusion, cosmétiques, bougies, etc. Il est également utilisé dans la synthèse de polyamides, comme le nylon, et des résines alkydes. Un isomère, l'acide isosébacique, a plusieurs applications dans la fabrication de plastifiants pour les résines vinyliques, de plastiques d'extrusion, d'adhésifs, de lubrifiants à base d'esters, de polyesters, de résines de polyuréthane et de caoutchouc synthétique.
- L'acide brassylique peut être produit à partir de l'acide érucique par ozonolyse, mais aussi par des micro-organismes (Candida) à partir du tridécane. Ce diacide est produit à petite échelle commerciale au Japon pour la fabrication de parfums[5].
- L'acide dodécanedioïque est utilisé dans la production de nylon (nylon-6,12), de polyamides, de revêtements, d'adhésifs, de graisses, de polyesters, de colorants, de détergents, de retardateurs de flamme et de parfums. Il est maintenant produit par fermentation d'alcanes à longue chaîne avec une souche spécifique de Candida tropicalis[5]. L'acide traumatique est sa forme monoinsaturée.
- L'acide thapsique a été isolé à partir des racines séchées de Thapsia garganica (Apiaceae).
La cire du Japon est un mélange contenant des triglycérides d'acides dicarboxyliques en C21, C22 et C23 obtenus à partir du sumac (Rhus)
Acides insaturés
[modifier | modifier le code]| Type | Nom commun | Nomenclature systématique | Isomère | Structure |
|---|---|---|---|---|
| Mono-insaturé | Acide maléique | acide (Z)-butènedioïque |
cis | 
|
| Acide fumarique | acide (E)-butènedioïque | trans | 
| |
| Acide cis-glutaconique | acide (Z)-pent-2-ènedioïque | cis | 
| |
| Acide trans-glutaconique | acide (E)-pent-2-ènedioïque | trans | 
| |
| Acide traumatique | acide dodéc-2-ènedioïque | trans | ||
| Di-insaturé | Acide muconique | acide (2E,4E)-hexa-2,4-diènedioïque | trans-trans | 
|
| acide (2Z,4E)-hexa-2,4-diènedioïque | cis-trans | 
| ||
| acide (2Z,4Z)-hexa-2,4-diènedioïque | cis-cis | 
| ||
| Acide glutinique | (RS)-acide penta-2,3-diènedioïque (en) | 
| ||
| Ramifié | Acide citraconique | acide (2Z)-2-méthylbut-2-ènedioïque | cis | 
|
| Acide mésaconique | acide (2E)-2-méthylbut-2-ènedioïque | trans | 
| |
| Acide itaconique | acide 2-méthylènebutanedioïque | – | 
|
- L'acide traumatique fait partie des premières molécules biologiquement actives isolées des tissus végétaux. Il a été démontré que cet acide dicarboxylique est un puissant agent de cicatrisation des plaies dans la plante qui stimule la division cellulaire près du site d'une plaie[6]. Il dérive des hydroperoxydes d'acides gras 18:2 ou 18:3 après conversion en acide gras oxo.
- L'acide trans,trans-muconique est un métabolite du benzène chez l'homme. Sa concentration dans l'urine est donc utilisée comme biomarqueur de l'exposition professionnelle ou environnementale au benzène[7],[8].
- L'acide glutinique, un allène substitué, a été isolé d'Alnus glutinosa (Betulaceae)[9].
Alors que les acides gras polyinsaturés sont inhabituels dans les cuticules des plantes, un acide dicarboxylique di-insaturé a été rapporté comme composant des cires ou des polyesters de surface de certaines espèces végétales. Ainsi, l'octadéca-c6,c9-diène-1,18-dioate, un dérivé de l'acide linoléique, est présent dans la cuticule d'Arabidopsis et de Brassica napus[10].
Alkylitaconates
[modifier | modifier le code]
Plusieurs acides dicarboxyliques ayant une chaîne latérale alkyle et un noyau itaconate ont été isolés à partir de lichens et de champignons, l'acide itaconique (acide méthylènesuccinique) étant un métabolite produit par des champignons filamenteux. Parmi ces composés, une famille d'analogue, appelés « acides chaetomelliques » avec différentes longueurs de chaîne et différents degrés d'insaturation, a été isolée à partir de diverses espèces du lichen Chaetomella. Ces molécules se sont révélées précieuses comme base pour le développement de médicaments anticancéreux en raison de leurs puissants effets inhibiteurs de la farnésyltransférase (en)[11].
Une série d'alkyl- et d'alcénylitaconates, connus sous le nom d'« acides cériporiques », ont été trouvés dans des cultures d'un champignon dégradant sélectivement la lignine (champignon de pourriture blanche), Ceriporiopsis subvermispora[12],[13]. La configuration absolue des acides cériporiques, leur voie de biosynthèse stéréosélective et la diversité de leurs métabolites ont été discutées en détail[14].
Acide aromatiques
[modifier | modifier le code]| Nom commun | Nomenclature systématique | Formule chimique | Structure |
|---|---|---|---|
| Acide phtalique | acide benzène-1,2-dicarboxylique acide o-phtalique |
C6H4(COOH)2 | 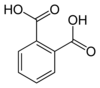
|
| Acide isophtalique | acide benzène-1,3-dicarboxylique acide m-phtalique |
C6H4(COOH)2 | 
|
| Acide téréphtalique | acide benzène-1,4-dicarboxylique acide p-phtalique |
C6H4(COOH)2 | 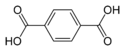
|
| Acide dipicolinique | acide pyridine-2,6-dicarboxylique |
C5H3N(COOH)2 | 
|
- L'acide téréphtalique est un produit chimique de base (en) utilisé dans la fabrication d'un polyester, le poly(téréphtalate d'éthylène) connu sous des noms commerciaux de PET, Terylene, Dacron ou Lavsan.
Notes et références
[modifier | modifier le code]- Gewert, Plassmann, Sandblom & MacLeod (2018) Identification of Chain Scission Products Released to Water by Plastic Exposed to Ultraviolet Light |Environmental Science & Technology Letters | 5 (5), pp 272–276 résumé
- (en) Boy Cornils, Peter Lappe, « Dicarboxylic Acids, Aliphatic », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a08_523)
- Ho Won Jung, Timothy J. Tschaplinski, Lin Wang, Jane Glazebrook et Jean T. Greenberg, « Priming in Systemic Plant Immunity », Science, vol. 324, no 3 April 2009, , p. 89–91 (PMID 19342588, DOI 10.1126/science.1170025, Bibcode 2009Sci...324...89W)
- Richard G. Kadesch, « Dibasic acids », Journal of the American Oil Chemists' Society, vol. 31, no 11, , p. 568–573 (DOI 10.1007/BF02638574)
- Kyle Kroha, « Industrial biotechnology provides opportunities for commercial production of new long-chain dibasic acids », Inform, vol. 15, , p. 568–571
- Edward E. Farmer, « Fatty acid signalling in plants and their associated microorganisms », Plant Molecular Biology, vol. 26, no 5, , p. 1423–1437 (PMID 7858198, DOI 10.1007/BF00016483)
- Wiwanitkit V, Soogarun S, Suwansaksri J, « A correlative study on red blood cell parameters and urine trans, trans-muconic acid in subjects with occupational benzene exposure », Toxicologic Pathology, vol. 35, no 2, , p. 268–9 (PMID 17366320, DOI 10.1080/01926230601156278)
- Weaver VM, Davoli CT, Heller PJ et al., « Benzene exposure, assessed by urinary trans,trans-muconic acid, in urban children with elevated blood lead levels », Environ. Health Perspect., vol. 104, no 3, , p. 318–23 (PMID 8919771, PMCID 1469300, DOI 10.2307/3432891, JSTOR 3432891)
- Sati, Sushil Chandra, Sati, Nitin et Sati, O. P., « Bioactive constituents and medicinal importance of genus Alnus », Pharmacognosy Reviews, vol. 5, no 10, , p. 174–183 (PMID 22279375, PMCID 3263052, DOI 10.4103/0973-7847.91115)
- SB Singh, H Jayasuriya, KC Silverman, CA Bonfiglio, JM Williamson et RB Lingham, « Efficient syntheses, human and yeast farnesyl-protein transferase inhibitory activities of chaetomellic acids and analogues. », Bioorganic & Medicinal Chemistry, vol. 8, no 3, , p. 571–80 (PMID 10732974, DOI 10.1016/S0968-0896(99)00312-0)
- Makiko Enoki, Takashi Watanabe, Yoichi Honda et Masaaki Kuwahara, « A Novel Fluorescent Dicarboxylic Acid, (Z)-1,7-Nonadecadiene-2,3-dicarboxylic Acid, Produced by White-Rot Fungus Ceriporiopsis subvermispora. », Chemistry Letters, vol. 29, no 1, , p. 54–55 (DOI 10.1246/cl.2000.54)
- Rudianto Amirta, Kenya Fujimori, Nobuaki Shirai, Yoichi Honda et Takashi Watanabe, « Ceriporic acid C, a hexadecenylitaconate produced by a lignin-degrading fungus, Ceriporiopsis subvermispora », Chemistry and Physics of Lipids, vol. 126, no 2, , p. 121–131 (PMID 14623447, DOI 10.1016/S0009-3084(03)00098-7)
- Hiroshi Nishimura, Kyoko Murayama, Takahito Watanabe, Yoichi Honda et Takashi Watanabe, « Absolute configuration of ceriporic acids, the iron redox-silencing metabolites produced by a selective lignin-degrading fungus, Ceriporiopsis subvermispora », Chemistry and Physics of Lipids, vol. 159, no 2, , p. 77–80 (PMID 19477313, DOI 10.1016/j.chemphyslip.2009.03.006)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dicarboxylic acid » (voir la liste des auteurs).
